Sul New England Journal Medicine, la rivista medica più autorevole in assoluto, sono stati appena pubblicati i risultati dello studio KEYNOTE-024, che ha confrontato, per la prima volta al mondo, un regime di chemioterapia standard con un immunoterapico (in questo caso il Pembrolizumab). Lo studio ha dimostrato la superiorità di quest’ultimo anche nella 1° linea di trattamento del cancro del polmone non a piccole cellule (NSCLC). Come c’era da aspettarsi, se ne è avuta subito un’ampia eco su tutti i media internazionali e nazionali che ne hanno riportato la notizia con grandi titoli ad effetto. Anche noi, nei nostri social media, ne abbiamo ripetutamente dato la notizia e qui sotto vi mostriamo l’ultimo post di ieri, in cui si rimandava all’intera copertura giornalistica delle ultimissime settimane…
Oggi vi presentiamo l’abstract (riassunto) dello studio che contiene i dati principali della ricerca, sia in versione originale che in Italiano, cui seguiranno alcune valutazioni del sottoscritto.
Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer (Il Pembrolizumab a confronto con la chemioterapia nel cancro non a piccole cellule del polmone PD-L1 positivo)
October 9, 2016DOI: 10.1056/NEJMoa1606774
BACKGROUND
Pembrolizumab is a humanized monoclonal antibody against programmed death 1 (PD-1) that has antitumor activity in advanced non–small-cell lung cancer (NSCLC), with increased activity in tumors that express programmed death ligand 1 (PD-L1).
INTRODUZIONE
Pembrolizumab è un anticorpo monoclonale umanizzato contro la proteina della morte programmata 1 (PD-1), che ha attività antitumorale nel carcinoma polmonare non a piccole cellule avanzato (NSCLC), con una maggiore attività nei tumori che ne esprimono il ligando 1 (PD-L1).
METHODS
In this open-label, phase 3 trial, we randomly assigned 305 patients who had previously untreated advanced NSCLC with PD-L1 expression on at least 50% of tumor cells and no sensitizing mutation of the epidermal growth factor receptor gene or translocation of the anaplastic lymphoma kinase gene to receive either pembrolizumab (at a fixed dose of 200 mg every 3 weeks) or the investigator’s choice of platinum-based chemotherapy. Crossover from the chemotherapy group to the pembrolizumab group was permitted in the event of disease progression. The primary end point, progression-free survival, was assessed by means of blinded, independent, central radiologic review. Secondary end points were overall survival, objective response rate, and safety.
METODI
In questo studio clinico di fase 3, abbiamo assegnato in modo casuale 305 pazienti, non precedentemente non trattati per un NSCLC avanzato con espressione di PD-L1 in almeno il 50% delle cellule tumorali, assenza di mutazione EGFR ed ALK, a ricevere Pembrolizumab (ad una dose fissa di 200 mg ogni 3 settimane) o un regime di chemioterapia a base di cisplatino, scelto in base alle preferenze del singolo sperimentatore. Il passaggio dal gruppo in chemioterapia al gruppo con Pembrolizumab, e viceversa, fu consentito in caso di progressione della malattia. L’obiettivo primario dello studio, ovvero la sopravvivenza libera da progressione, è stata valutata mediante valutazione radiologica centrale, indipendente e all’oscuro di ogni informazioni riguardante il trattamento effettuato. Gli obiettivi secondari erano la sopravvivenza globale, il tasso di risposta obiettiva, e la tossicità.
RESULTS
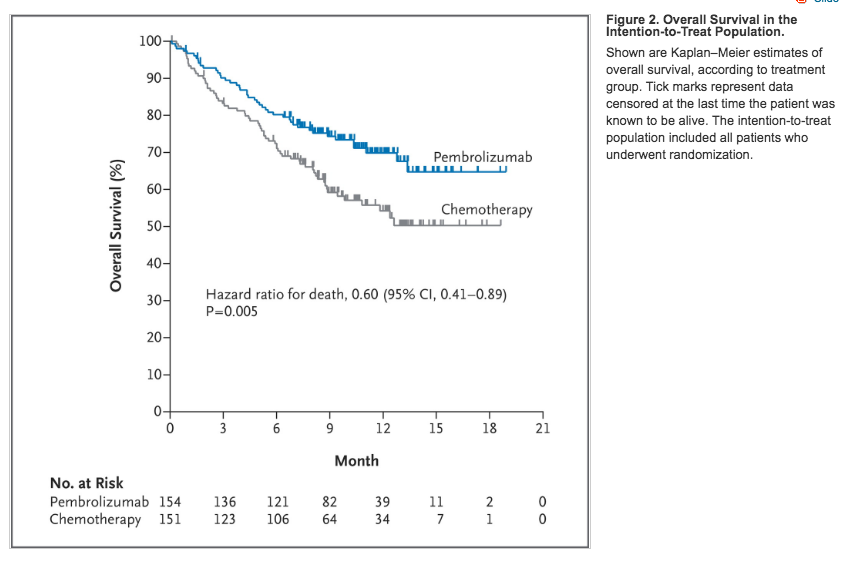
Median progression-free survival was 10.3 months (95% confidence interval [CI], 6.7 to not reached) in the pembrolizumab group versus 6.0 months (95% CI, 4.2 to 6.2) in the chemotherapy group (hazard ratio for disease progression or death, 0.50; 95% CI, 0.37 to 0.68; P<0.001). The estimated rate of overall survival at 6 months was 80.2% in the pembrolizumab group versus 72.4% in the chemotherapy group (hazard ratio for death, 0.60; 95% CI, 0.41 to 0.89; P=0.005). The response rate was higher in the pembrolizumab group than in the chemotherapy group (44.8% vs. 27.8%), the median duration of response was longer (not reached [range, 1.9+ to 14.5+ months] vs. 6.3 months [range, 2.1+ to 12.6+]), and treatment-related adverse events of any grade were less frequent (occurring in 73.4% vs. 90.0% of patients), as were grade 3, 4, or 5 treatment-related adverse events (26.6% vs. 53.3%).
RISULTATI
La sopravvivenza mediana libera da progressione è stata di 10,3 mesi (intervallo di confidenza [CI] al 95%: da 6.7 mesi a un tempo non ancora raggiunto) nel gruppo pembrolizumab, rispetto a 6,0 mesi (95% CI: 4,2-6,2) nel gruppo della chemioterapia (rischio per la progressione della malattia= 0,50; 95% CI: 0,37-0,68; p <0.001). Il tasso stimato di sopravvivenza globale a 6 mesi era 80,2% nel gruppo Pembrolizumab contro il 72,4% nel gruppo chemioterapia (rischio di morte= 0.60; 95%; CI: 0,41-0,89; P = 0.005). Il tasso di risposta è stata più alta nel gruppo Pembrolizumab che nel gruppo chemioterapia (44,8% vs. 27,8%), la durata mediana della risposta è stata più lunga (non raggiunta [intervallo: 1.9+ di 14.5+ mesi] vs. 6,3 mesi [intervallo: 2.1+ di 12.6+]), e gli eventi avversi correlati al trattamento di qualsiasi grado sono stati meno frequenti (si verificano in 73,4% contro il 90,0% dei pazienti), così come quelli di grado 3, 4, o 5 (26,6% vs 53,3%).
CONCLUSIONS
In patients with advanced NSCLC and PD-L1 expression on at least 50% of tumor cells, pembrolizumab was associated with significantly longer progression-free and overall survival and with fewer adverse events than was platinum-based chemotherapy. (Funded by Merck; KEYNOTE-024 ClinicalTrials.gov number, NCT02142738.)
CONCLUSIONI
Nei pazienti con NSCLC avanzato ed espressione di PD-L1 su almeno il 50% delle cellule tumorali, Pembrolizumab è stata associato ad un tempo significativamente più lungo di malattia libera da progressione e a una sopravvivenza globale prolungata, con un minor numero di eventi avversi di quanto non fosse provocato dalla chemioterapia a base di platino. (Finanziato da Merck; KEYNOTE-024 numero ClinicalTrials.gov, NCT02142738).
COMMENTI:
Pro:
- Abbiamo già sottolineato l’importanza dello studio e le sue ricadute sul trattamento standard del cancro del polmone avanzato, e riteniamo non sia necessario ulteriormente ribadirla.
- I dati, in sé, sono effettivamente clamorosi per il cancro del polmone. Che un nuovo trattamento riduca il rischio di progressione della malattia (si noti, però, che si tratta di rischio a 6 mesi) del 50% e di morte del 40% (come sottolineato in molti titoli di giornale), a mia memoria almeno, non era mai avvenuto in questo tumore così refrattario ad ogni tentativo di cura!
- Lo studio è ben condotto, ed è analizzato con assoluto rigore scientifico (d’altra parte, se così non fosse, non sarebbe passato dal setaccio dei revisori della prestigiosa rivista medica).
Contro:
- Nonostante si tratti di un ampio sforzo cooperativo internazionale, il numero dei pazienti randomizzati e valutabili non è particolarmente alto, il che determina un problema di generalizzazione dei risultati in mancanza di altri studi probatori.
- Lo studio è finanziato dal principale attore in causa: la compagnia farmaceutica che produce il farmaco in questione, la MSD. Sebbene ciò non impedisca che risultati negativi vengano fuori e siano ugualmente diffusi alla stampa, pur costituendo ciò un possibile nocumento economico per la multinazionale che ha finanziato lo studio (recentissimo il caso della BMS, casa produttrice del concorrente Nivolumab..), per tranquillità uno vorrebbe esser certo che nessun “bias” (pregiudizio favorevole), anche non coscientemente, possa aver influenzato i risultati…
Cosa succederà adesso?…. A me personalmente piacerebbe vedere questi risultati confermati da altri ricercatori indipendenti e magari sul altri immunoterapici, prima di prendere una decisione definitiva. Ma, ne son certo, ciò non avverrà o non avverrà presto, e ciò nonostante tutti cominceranno a considerare chiusa la questione e osserveremo un progressivo un passaggio “spontaneo” dalla chemioterapia all’immunoterapia, che poi verrà sancito ufficialmente da qualche importante congresso, per poi entrare a pieno titolo nelle raccomandazioni al trattamento delle principali società scientifiche oncologiche del pianeta…
IL PASSAGGIO DALLA CHEMIO ALL’IMMUNOTERAPIA E’ GIA’ INIZIATO!
Gianfranco Buccheri



Leave a Reply